R&D and market size: Who benefits from orphan drug legislation?
Gamba S., Magazzini L., Pertile P., 2021 – Journal of Health Economics
È ampiamente riconosciuto che lo sviluppo di nuove tecnologie sanitarie è un fattore fondamentale tra quelli che hanno contribuito all’aumento dell’aspettativa di vita registrata nella maggior parte dei Paesi. Sebbene il quadro generale appaia rassicurante, non possiamo ignorare che non tutti i pazienti hanno beneficiato allo stesso modo di questi sviluppi. Gli aspetti tecnici del processo di scoperta dei farmaci possono spiegare il mancato sviluppo in alcune aree cliniche. Tuttavia, anche le ragioni economiche possono giocare un ruolo centrale, come nel caso delle malattie rare, per le quali le dimensioni ridotte del mercato potenziale fanno sì che gli incentivi per l’industria privata a investire in queste aree cliniche sia spesso insufficiente. Anche se una singola malattia rara di solito colpisce pochissime persone, attualmente in letteratura sono descritte più di 7.000 malattie “orfane” e si stima che tra i 27 e i 36 milioni di residenti nell’UE soffrano di una di queste malattie. L’aspetto più sorprendente è che per meno del 10% delle malattie rare conosciute è disponibile un trattamento con un’indicazione specifica. Ciò rende le malattie rare un problema di salute pubblica enorme e in gran parte irrisolto.
La consapevolezza di questo problema ha portato diversi Paesi a introdurre una legislazione speciale, a partire dall’approvazione dell’Orphan Drug Act (ODA) nel 1983 negli Stati Uniti. Negli anni successivi, altri Paesi hanno preso iniziative simili, tra cui il Giappone nel 1993 e l’Unione Europea nel 2000. Il pacchetto di incentivi è simile, anche se non perfettamente sovrapponibile, nelle varie aree geografiche e comprende incentivi sia di tipo pull sia di tipo push. Gli incentivi di tipo pull, come per esempio la market exclusivity — forma particolarmente forte di protezione del mercato — si caratterizzano per il fatto di produrre effetti una volta che il prodotto viene commercializzato. Diversamente, gli incentivi di tipo push, quali per esempio i crediti d’imposta, operano attraverso una riduzione del costo del processo di R&S, a prescindere dall’esito. Indipendentemente dal tipo di incentivo, la possibilità per l’azienda di beneficiarne è condizionata al fatto che il prodotto ottenga la Orphan Drug Designation (ODD) da parte dell’autorità regolatoria di competenza.
Ma questa legislazione speciale sta funzionando? Se la domanda è se abbia contribuito a ridurre le differenze in termini di investimenti in R&S tra malattie orfane e non orfane, la letteratura è sostanzialmente concorde sul fatto che questo obiettivo sia stato raggiunto. Basandosi sui dati forniti dalla Federal Drug Administration (FDA) degli USA, la Figura 1 confronta le variazioni nel tempo di una misura di intensità della ricerca farmaceutica specifica nelle malattie rare (Orphan Drug Designations) con una di carattere generale (Investigational New Drugs). Dalla figura si vede chiaramente che la crescita è stata nettamente superiore per le malattie rare, soprattutto a partire dal 2000.
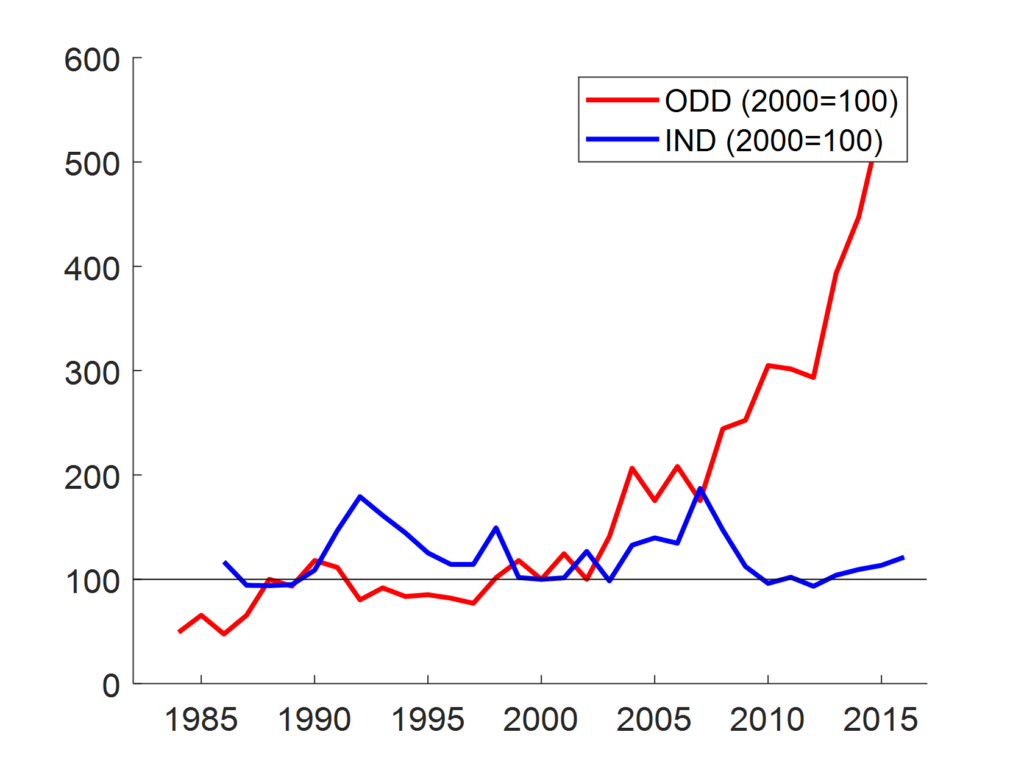
Tuttavia, a partire da queste evidenze, è naturale porsi un ulteriore quesito: a chi vanno i benefici di questa legislazione?
In un recente articolo, “R&D and market size: Who benefits from orphan drug legislation?”, pubblicato sul Journal of Health Economics, Simona Gamba, Laura Magazzini e Paolo Pertile approfondiscono questo tema e studiano come l’impatto degli incentivi cambi a seconda della prevalenza della malattia. Infatti, alcune malattie orfane colpiscono diverse centinaia di migliaia di persone in tutto il mondo, mentre altre hanno registrato pochissimi casi. Pertanto, sebbene le dimensioni del mercato di una malattia orfana siano tipicamente contenute, in alcuni casi lo sono molto più che in altri.
L’analisi degli autori si sviluppa a partire da un modello teorico in cui le imprese farmaceutiche prendono due decisioni. La prima è se investire o meno nel processo di R&S sulla base del confronto tra ricavi e costi attesi. In caso di risposta positiva, l’ulteriore decisione riguarda la dimensione dell’investimento. Incrementando l’ammontare investito l’impresa aumenta la probabilità di successo del processo di R&S. Come è facilmente intuibile, gli incentivi, a prescindere dalla tipologia, aumentano la propensione all’investimento. Tuttavia, i meccanismi attraverso cui operano gli incentivi di tipo pull e push sono diversi. In particolare, gli incentivi pull tendono ad aumentare il divario nella propensione a investire a svantaggio delle malattie molto rare, più di quanto non facciano gli incentivi push.
Gli autori testano quindi questi risultati teorici combinando diverse fonti di informazione, tra cui il database di Orphanet contenente informazioni cliniche sulle malattie orfane e i dati della FDA relativi alla concessione delle ODD. La Figura 2 mostra il numero atteso di ODD per tre diverse classi di prevalenza all’interno della categoria delle malattie orfane: malattie ultra-rare (C1: <1/1,000,000), intermedie (C23: 1/1,000,000-9/100,000) e relativamente poco rare (C4: 1-5/10,000). Il numero atteso di ODD è calcolato sulla base dei parametri stimati di un modello Zero-Inflated Negative Binomial che combina la decisione se investire o meno con quella relativa alla dimensione dell’investimento (condizionatamente all’aver scelto di investire).
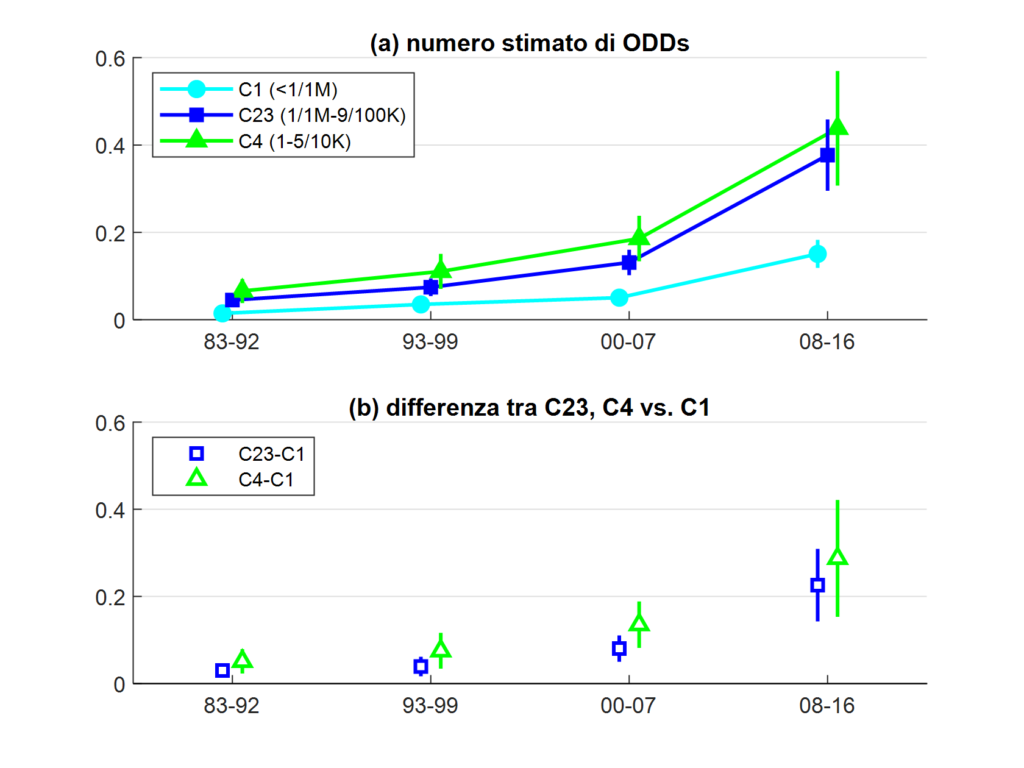
La figura mostra che nel tempo il divario a favore delle malattie meno rare è aumentato in modo sostanziale. In particolare, la differenza tra il numero annuo atteso di ODD per una malattia nella classe di prevalenza più alta e in quella più bassa è 5,6 volte maggiore dopo il 2008 rispetto al periodo 1983-1992. In base all’analisi teorica proposta dagli autori, è probabile che il tipo di incentivi utilizzato abbia contribuito a questa dinamica. Ciò è particolarmente vero per la legislazione europea introdotta nel 2000, che rispetto ad altre tende ad essere più sbilanciata a favore degli incentivi pull.
I risultati di questa ricerca sono rilevanti in termini di implicazioni di policy, dal momento che in Europa è attualmente in corso un processo di riforma della regolamentazione farmaceutica, compresa quella sui farmaci orfani. Come si potrebbe rivedere il sistema di incentivi per ridurre il numero di malattie per le quali non esiste alcuna opzione terapeutica? La presente analisi suggerisce che il rafforzamento degli incentivi di tipo push, particolarmente deboli nell’attuale legislazione europea, potrebbe essere d’aiuto. Tuttavia, per raggiungere l’obiettivo potrebbero rendersi necessari cambiamenti più radicali. Il sistema attuale si fonda su una definizione di malattia orfana basata su un indicatore semplice di prevalenza (meno di 5 su 10.000). Il sistema di incentivi è quindi lo stesso per tutte le malattie classificate come orfane. Se fornire almeno un’opzione terapeutica ai pazienti affetti da malattie molto rare è una priorità, allora gli incentivi dovrebbero essere adattati alla specifica prevalenza della malattia anche all’interno della classe generale delle malattie orfane. In alternativa, si potrebbero concepire forme di incentivi più forti per le malattie senza opzioni terapeutiche esistenti o per quelle con una numerosità di casi affetti particolarmente elevata. Un’ulteriore strada da esplorare potrebbe essere la creazione di un’infrastruttura pubblica che si concentri sulle aree di ricerca che non attraggono sufficienti investimenti privati nel panorama attuale.
Per ulteriori dettagli sul processo di riforma della legislazione farmaceutica europea, si veda:

